體外診斷試劑產品注冊技術審評報告
產品中文名稱:結核分枝桿菌復合群核酸檢測試劑盒(PCR-熒光探針法)
北京市北京經濟技術開發區康定街1號14號樓3層1室
北京市北京經濟技術開發區康定街1號14號樓2層、北京市北京經濟技術開發區康定街1號10號樓2層
技術審評概述
一、產品概述
(一)產品主要組成成分
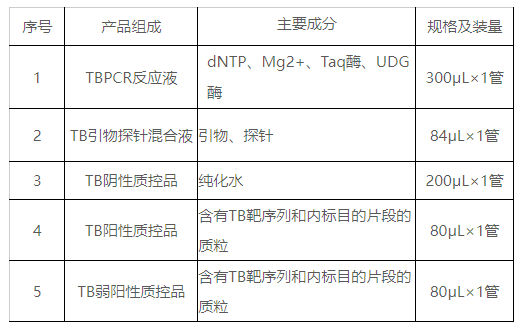
本試劑盒含有TBPCR反應液、TB引物探針混合液、TB陰性質控品、TB陽性質控品、TB弱陽性質控品,主要組成成分見表1。
表1試劑盒主要組成成分
本試劑盒用于體外定性檢測人福爾馬林固定、石蠟包埋組織樣本中的結核分枝桿菌復合群核酸。
本產品采用PCR熒光探針技術,用于輔助結核病的病理診斷。
結核分枝桿菌(tuberclebacilli,TB)復合群主要包括結核分枝桿菌、牛結核分枝桿菌、非洲分枝桿菌和田鼠分枝桿菌,除田鼠分枝桿菌外,其余三種均對人致病,是結核病的病原菌,可通過呼吸道、消化道和破損的皮膚粘膜進入機體,侵犯多種組織器官,引起相應器官的結核病,以肺結核最常見。其致病作用可能與細菌在組織細胞內頑強增殖引起炎癥反應,以及誘導機體產生遲發型變態反應性損傷有關。TB基因組中的插入序列IS6110具有特異性強,重復性好的特點,是TB檢測常用的靶基因片段。
實驗操作人員應接受過基因擴增或分子生物學方法檢測的專業培訓,具備相關的實驗操作資格,實驗室應具備相關的生物安全防備設施及防護程序。
該產品檢測結果應結合患者臨床癥狀、體征、流行病學背景及其他臨床診斷結果進行綜合判斷,不得作為疾病診斷的唯一標準。
本產品檢測的靶基因為TB基因組中的插入序列IS6110,該序列作為靶基因具有特異性強,重復性好等特性。內標為Her2基因,在人基因組中表達穩定,是常見的管家基因。本產品采用熒光PCR技術,選取結核分枝桿菌基因組中相對保守的區域,設計特異性引物及探針,在樣本提取之后采用熒光PCR對TBDNA進行快速檢測。
本產品采用了Taqman熒光探針技術,其試劑比常規PCR試劑多了一個寡聚核苷酸探針,這個探針帶有一個熒光發光基團和一個熒光淬滅基團,完整的探針在特定光源激發下,發光基團所產生的熒光被淬滅基團全部吸收,樣品無熒光。PCR過程中,Taq酶在延伸DNA鏈的同時,可通過自身的5’→3’核酸外切酶活性降解與模板結合的特異性熒光探針,使熒光報告基團與淬滅基團分離,分離后的熒光報告基團在特定光源激發下產生熒光。通過監測整個PCR過程熒光信號的變化,對未知模板進行定性分析。
同時本產品采用內標質控體系,用于監測反應體系可能存在的抑制因素。內標質控品與靶基因無同源性,內標探針選擇的是與靶基因探針沒有沖突的另一檢測通道。
本試劑盒主要原材料包括:引物、探針、qPCRMasterMix、UDG酶、dUTP、TB菌液。其中引物、探針為申請人自行設計后由專業的合成公司合成,其他原材料均為外購方式獲得。申請人選擇有資質的供應商提供的原料,通過功能性試驗,篩選出最佳原材料和供應商,并制定了各主要原材料的質量標準并經檢驗合格。
企業參考品設置情況:申請人設計了完整的企業參考品,包括陽性參考品、陰性參考品、最低檢出限參考品和精密度參考品。其中:
陽性參考品共15份,包括肺結核樣本、右側頸結核樣本、淋巴結核樣本、非洲分枝桿菌樣本、骨結核樣本、左肩結核樣本、腎結核樣本、腰椎結核樣本、左胸結核樣本、直腸結核樣本、胸壁結核樣本、BCG菌株和結核分枝桿菌菌株,濃度在1×103copies/mL~5×105copies/mL之間。
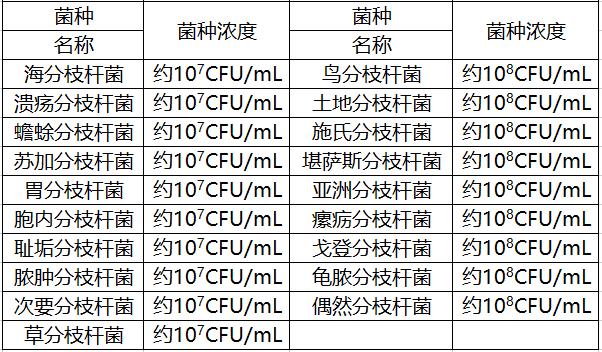
陰性參考品共15份,包括浸潤性腺癌樣本、肺癌樣本、慢性肺部炎癥樣本、間質性肺炎樣本、肺鱗狀細胞癌樣本、人流感病毒A型菌株、人流感病毒B型菌株、膿腫分枝桿菌、蟾蜍分枝桿菌、鳥分枝桿菌、蘇加分枝桿菌和海分枝桿菌,其中菌株的濃度均為106CFU/mL。
最低檢出限參考品共8份,包括肺結核樣本、非洲分枝桿菌樣本、淋巴結核樣本、骨結核樣本、右頸結核樣本、腰椎結核樣本、BCG菌株和結核分枝桿菌菌株,濃度均為1×103copies/mL。
精密度參考品共2份,均為肺結核樣本,濃度分別為1×106copies/mL和1×104copies/mL。
申請人通過對試劑主要生產工藝的研究,確定了最佳生產工藝。
申請人對反應體系中的TBPCR反應液、引物探針序列、引物探針濃度、樣本的上樣量、內標體系和UDG酶體系的干擾、退火溫度、反應循環數等進行篩選和優化,通過功能性試驗,最終確定了最佳反應體系。
該產品的分析性能包括核酸提取純化、準確性、精密度、最低檢出限、分析特異性(交叉反應和干擾試驗)、包容性、不同部位組織的評估等。申請人提交了有效運行的質量管理體系下生產的三批產品在適用機型上的性能評估資料。
在核酸提取純化研究中,申請人采用臨床石蠟包埋組織樣本,平行比較了2種石蠟包埋組織核酸提取試劑盒的提取效果,根據與該產品的組合性能研究,確定了1種核酸提取試劑盒,與該產品配套使用。
在準確性研究中,申請人采用三批試劑盒檢測15份企業陽性參考品(1×103copies/mL~5×105copies/mL)和15份企業陰性參考品(其中菌株濃度為106CFU/mL),結果顯示:陽性符合率和陰性符合率均為100%。
在精密度研究中,申請人采用三批試劑盒,檢測陰性樣本(不含結核分枝桿菌復合群)、弱陽性樣本(濃度為2×103copies/mL)和中等陽性樣本(濃度為5×105copies/mL),分別評估了批內、批間、日間、不同操作者之間以及不同實驗地點之間的精密度。結果顯示:檢測結果Ct值的CV值均小于5%,表明本產品的批內、批間、日間、不同操作者間以及不同實驗地點間的重復性均符合要求。同時,對低濃度的石蠟包埋組織樣本進行提取精密度檢測,結果顯示:提取后臨床樣本的DNA濃度及純度差異較小,檢測結果Ct值的CV值均小于5%,說明石蠟包埋組織樣本經多次提取的DNA質量及檢測結果一致性符合要求。
在最低檢出限研究中,申請人將結核分枝桿菌、牛結核分枝桿菌石蠟樣本分別與陰性石蠟樣本混合,采用三批成品試劑盒檢測,最終確定并驗證了本試劑盒的最低檢出限為1×103copies/mL。
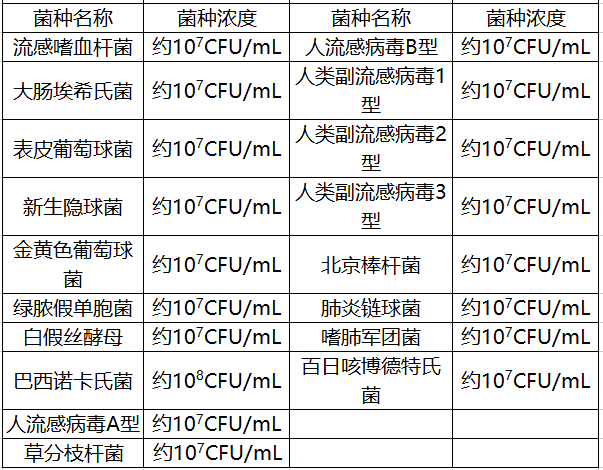
在交叉反應研究中,申請人采用三批試劑盒,對易產生交叉反應的病原體與可能引發臨床相似癥狀的病原菌進行了研究,包括19種非結核分枝桿菌復合群的其他分枝桿菌以及其他17種病原體。
本產品對以上36種病原菌的檢測結果全部為陰性。
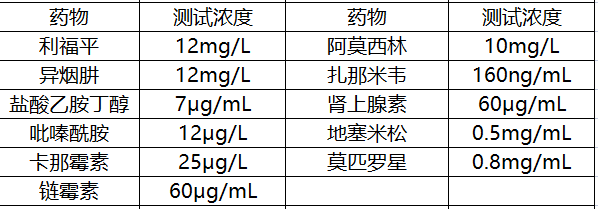
在干擾試驗中,申請人對外源及內源干擾物質,肺癌樣本、肺部良性疾病樣本及肺部肉芽腫樣本進行了研究。
結果顯示:低于上述測試濃度的藥物不會對本產品的檢測結果產生干擾。
對其他外源性干擾物質10%福爾馬林(0.05v/v)、95%乙醇(0.05v/v)進行研究,同時對內源性干擾物質血紅素(0.02g/mL)、粘液(0.05v/v)、血紅蛋白(0.2g/mL)、人基因組(2.5μg/mL)進行研究,結果顯示:低于上述濃度的干擾物質不會對本產品的檢測結果產生干擾。
采用肺癌樣本、肺部良性疾病樣本及肺部肉芽腫樣本(共20余例)分別進行提取檢測,結果顯示:檢測結果全部為陰性,以上樣本類型不會干擾本試劑盒的檢測能力。
在包容性研究中,申請人采用三批試劑盒,檢測結核分枝桿菌、牛結核分枝桿菌、非洲分枝桿菌和田鼠分枝桿菌。結果顯示:本產品對結核分枝桿菌(濃度為103copies/mL)、牛結核分枝桿菌(濃度為1×103copies/mL)、非洲分枝桿菌(濃度為2×103copies/mL)和田鼠分枝桿菌(濃度為2×103copies/mL)均能100%檢出。
不同部位組織的評估:選擇不同部位的結核病組織樣本,包括睪丸結核、淋巴結核、腎結核、手指結核、胸壁結核、胸腔結核、胸椎結核、腰椎結核、右頸結核、右膝結核、直腸結核、左頸結核、左胸結核、左腰結核,提取核酸后,采用陰性樣本稀釋至最低檢出限,用三批試劑分別對其檢測20次,檢測結果均為陽性,與測序結果一致。
(四)陽性判斷值
申請人采用ROC曲線法確定陽性判斷值。申請人采用本產品對237例臨床石蠟包埋組織樣本(178個結核分枝桿菌復合群陽性樣本和59個結核分枝桿菌復合群陰性樣本)進行檢測,結果顯示:當靶基因通道Ct值為37左右時,本產品的靈敏度和特異性達到最佳。所以確定本產品的陽性判斷值為37,并確定以下判讀方法:

注:高濃度樣本(Ct值≤15),由于競爭抑制,內標通道無S型擴增曲線屬于正常情況,建議標本進行梯度稀釋后進行檢測。
申請人采用申報產品對17例灰區樣本進行復檢驗證,結果顯示:復檢后的結果與測序驗證的結果一致性可達到90%以上。
(五)穩定性研究
申請人對本產品的實時穩定性、運輸穩定性、開瓶及凍融穩定性等進行了研究,確定了在各種條件下本產品的有效保存時間。同時,對石蠟包埋組織樣本的常溫放置穩定性、石蠟包埋組織提取的DNA冷凍穩定性進行了研究,確定了臨床樣本的有效保存時間。
實時穩定性研究:將三批儲存于-20±5℃條件下的申報產品經過長途高溫運輸后寄回,分別在申報產品生產后的第0、4、8、12、14個月檢測企業參考品,結果顯示:在上述各時間點檢測企業參考品的各項性能指標均符合要求。因此確定申報產品的效期穩定性為:-20±5℃避光保存,有效期12個月。
三、臨床評價概述
申請人在首都醫科大學附屬北京胸科醫院、河南省人民醫院和武漢市肺科醫院共3家臨床試驗機構完成了臨床試驗。采用試驗用體外診斷試劑與Sanger測序法及病理診斷結果進行比較研究的方法,對產品臨床性能進行評價。入組病例包括肺結核、肺外結核以及肺癌、非結核分枝桿菌感染、真菌感染等其他易混淆疾病患者,樣本類型為石蠟包埋組織樣本。臨床試驗共入組受試者604例,其中陽性樣本400例,陰性樣本204例。試驗結果顯示,申報產品與Sanger測序檢測陽性符合率為99.25%(95%CI:97.82%,99.85%),陰性符合率為95.59%(95%CI:91.79%,97.96%);與病理診斷對比,靈敏度為92.78%(95%CI:89.07%,95.53%),特異度為96.39%(95%CI:89.80%,99.25%)。綜上所述,該產品臨床試驗設計符合《體外診斷試劑臨床試驗技術指導原則》的相關要求,臨床試驗結果顯示該產品與對比方法一致性較好,臨床性能滿足臨床需求。
四、產品受益風險判定
根據申請人提供的申報資料,經綜合評價,在目前認知水平上,認為該產品能夠較大程度地滿足醫療需求,預期為適用人群帶來的受益大于風險。但為保證用械安全,基于對主要剩余風險的規避,需在說明書中提示以下信息:
該產品檢測結果應結合患者臨床癥狀、體征、流行病學背景及其他臨床診斷結果進行綜合判斷,不得作為疾病診斷的唯一標準。
綜合評價意見
本申報項目為境內第三類醫療器械產品注冊,屬于境內同品種首個產品。申請人的注冊申報資料符合現行要求,依據《醫療器械監督管理條例》(國務院令第680號)、《體外診斷試劑注冊管理辦法(國家食品藥品監督管理總局令2014年第5號)等相關醫療器械法規與配套規章,經系統評價后,建議準予注冊。