
體外診斷試劑產(chǎn)品注冊技術(shù)審評報告?
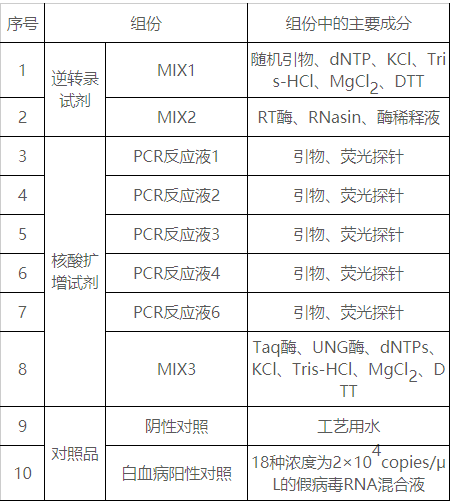
表1試劑盒主要組成成分
(二)產(chǎn)品預期用途
本試劑盒用于體外定性檢測急性髓系白血病(AML)、急性淋巴細胞白血病(ALL)、以及其他混合表型白血病和前期診斷未明確分型的白血病患者骨髓樣本中的BCR-ABL、SIL-TAL1、E2A-HLF、TEL-AML1、MLL-AF4、E2A-PBX1、AML1-ETO、MLL-AF9、PML-RARα、MLL-AF6、MLL-AF10、MLL-ELL、MLL-ENL、CBFβ-MYH11和DEK-CAN共15種白血病相關融合基因(其中MLL-AF6、MLL-AF10、MLL-ELL和MLL-ENL四種融合基因不能鑒別分型)。
本產(chǎn)品用于輔助白血病診斷與分型、臨床藥物的選擇及評估疾病預后。
本產(chǎn)品通過對臨床骨髓標本中的白血病相關融合基因的RNA逆轉(zhuǎn)錄后,對相應的cDNA進行定性檢測,以確定其融合基因的類型,從而及時輔助白血病臨床診斷、臨床藥物的選擇及評估疾病預后提供重要信息。本試劑盒檢測結(jié)果僅供臨床參考,不得作為臨床診斷的唯一標準。建議結(jié)合患者臨床表現(xiàn)和其他實驗室檢測對病情進行綜合分析。
(三)產(chǎn)品包裝規(guī)格
20測試/盒
(四)產(chǎn)品檢驗原理
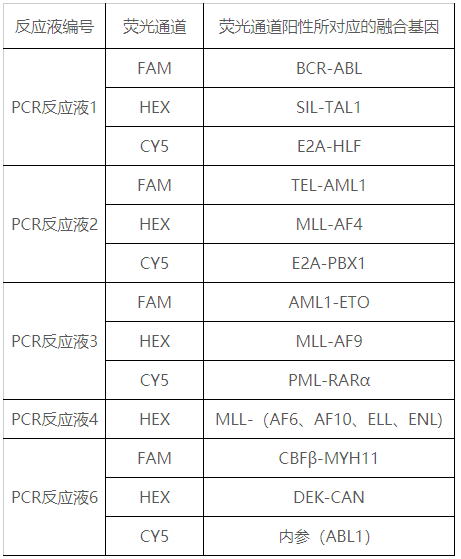
本產(chǎn)品由白血病相應融合基因特異性引物、熒光探針、RT酶及Taq酶等成分組成,采用核酸擴增技術(shù)結(jié)合熒光標記探針雜交方法,通過熒光信號的變化,利用熒光標記定性檢測人骨髓標本中的白血病相關融合基因RNA的轉(zhuǎn)錄產(chǎn)物cDNA。本試劑盒還使用尿苷酶(UNG)防污染體系,經(jīng)加熱可選擇性地降解U-DNA,以防止先前PCR擴增產(chǎn)物的污染;采用內(nèi)參基因(ABL1),控制整個試劑盒檢測過程的有效性。?
二、臨床前研究概述
(一)主要原材料
1.主要原材料的選擇
本試劑盒主要原材料包括:本產(chǎn)品在制備過程中主要原材料包括陽性對照原液、引物和探針、Taq酶、UNG酶、RT酶和RNasin酶。其中引物、探針為申請人自行設計后由專業(yè)的合成公司合成,陽性對照原液為企業(yè)自制,其他原材料均為外購方式獲得。申請人選擇有資質(zhì)的供應商提供的原料,通過功能性試驗,篩選出最佳原材料和供應商,并制定了各主要原材料的質(zhì)量標準并經(jīng)檢驗合格。
2.企業(yè)參考品設置情況
申請人設計了完整的企業(yè)參考品,包括準確性參考品、分析特異性參考品、檢測限參考品和精密度參考品。其中:
準確性參考品共28份,包括檢定合格的相應白血病融合基因陽性假病毒或內(nèi)參基因假病毒,RNA濃度為3×104copies/μL。
分析特異性參考品共3份,包括骨髓細胞裂解物、HL60細胞株裂解物、Jurkat細胞株裂解物各1份,抽提為RNA,RNA濃度為3×104copies/μL。
檢測限參考品共18份,包括檢定合格的相應白血病融合基因陽性假病毒或內(nèi)參基因假病毒,抽提為RNA后配制,終濃度為每種RNA 800copies/μL。
精密度參考品共10份,包括檢定合格的相應白血病融合基因陽性假病毒或內(nèi)參基因假病毒,抽提為RNA后配制,高濃度精密度的終濃度為每種RNA 2×104copies/μL,低濃度精密度的終濃度為每種RNA 2×103copies/μL。
(二)生產(chǎn)工藝及反應體系研究
申請人通過對試劑主要生產(chǎn)工藝的研究,確定了最佳生產(chǎn)工藝。
申請人對反應體系中的引物、探針的組合;引物濃度、探針濃度;緩沖液的選擇;Taq酶、UNG酶用量;退火溫度,退火時間,反應循環(huán)數(shù),變性溫度和時間;樣本的上樣量,抽提方法的選擇;樣本提取RNA質(zhì)量要求;融合基因組合檢測的設置等進行篩選和優(yōu)化。通過功能性試驗,最終確定了最佳反應體系。
(三)分析性能評估
分析性能包括核酸提取純化、準確性、精密度、最低檢出限、分析特異性(交叉反應和干擾試驗)的評估等。申請人提交了有效運行的質(zhì)量管理體系下生產(chǎn)的三批產(chǎn)品在適用機型上的性能評估資料。
在核酸提取純化研究中,申請人評價了抽提方法的提取效率、提取RNA濃度的重復性、RNA純度和抗干擾能力,確定了一種抽提試劑盒與該產(chǎn)品配套使用。
在準確性研究中,申請人檢測企業(yè)準確性參考品和64例不同融合類型的陽性臨床樣本結(jié)果顯示:陽性符合率均為100%。
在分析特異性研究中,申請人檢測包括3份企業(yè)特異性參考品樣本和8例融合基因陰性的臨床樣本,其陰性符合率為100%。
試劑盒檢測6例SET-NUP214、NUP98-HOXA9、TLS-ERG融合基因陽性白血病患者骨髓血樣本提取的核酸,其陰性符合率為100%。申請人選擇4例融合基因陰性骨髓樣本,通過添加的形式,分別研究HBV病毒、CMV病毒、HCV病毒和EBV病毒對檢測結(jié)果的影響,試驗結(jié)果顯示試劑盒不受上述病原體的影響。干擾試驗研究結(jié)果表明,輕度溶血的全血樣本(即Hb濃度≤3g/L)、重度脂血的全血樣本(TG濃度為20mmol/L)、重度黃疸的全血樣本(T-Bil含量為172umol/l)對檢測結(jié)果無干擾。2.5倍治療水平濃度的常見藥物和治療白血病的靶向藥物,阿莫西林,阿司匹林、維甲酸、伊馬替尼、阿糖胞苷、長春新堿、柔紅霉素、亞砷酸、左旋門冬酰胺酶、環(huán)磷酰胺和氟達拉濱研究結(jié)果顯示藥物對檢測結(jié)果無影響。
在精密度研究中,申請人采用三批試劑盒,對各精密度參考品,進行批次內(nèi)/間、試驗日內(nèi)/間、試驗輪次內(nèi)/間、操作者間、實驗室間精密度研究,CV值≤5%。試劑盒對18例臨床樣本進行三批產(chǎn)品的精密度試驗,均能檢出,且其實驗數(shù)據(jù)CV值≤5%。對15例臨床樣本進行20天精密度試驗,從批次內(nèi)、批次間、不同儀器、試驗操作者間、實驗室間精密度進行研究,檢測結(jié)果均能檢出,且其實驗數(shù)據(jù)CV值≤5%。
在最低檢出限研究中,申請人采用相應白血病融合基因陽性樣本或內(nèi)參基因假病毒分別稀釋至10000copies/反應、1000copies/反應、100copies/反應確定試劑盒檢測限。申請人采用覆蓋聲稱靶基因類型的陽性標本與陰性樣本稀釋至檢測限附近進行最低檢出限的驗證,結(jié)果顯示所有樣本重復20次,均≥95%檢出。
(四)陽性判斷值
申請人采用ROC曲線法確定陽性判斷值。申請人采用69個不同融合基因型陽性樣本和47個陰性樣本進行檢測,建立檢測試劑的陽性判斷值,申請人選取18例白血病相應15種融合基因陽性和10例相應15種融合基因陰性共28例臨床診斷結(jié)果明確的標本來驗證試劑盒的準確性。檢測結(jié)果顯示建立的陽性判斷值可以滿足試劑盒對于臨床樣本準確性的要求。
申請人選取125例臨床樣本,包含覆蓋聲稱靶基因陽性樣本、檢測融合基因范圍外的融合類型陽性樣本和融合基因陰性樣本。對建立的陽性判斷值進行驗證。檢測結(jié)果顯示建立的陽性判斷值可以滿足試劑盒對于臨床樣本的檢測。最終確定以下判讀方法:
因不同反應液、不同熒光通道檢測不同的融合基因,因此,每個樣本在分析中,必須逐一對不同的反應液、同一反應液中的不同通道分別分析,即必須逐一將樣本、陽性對照、陰性對照同時分析其在各個反應液中的三種熒光擴增曲線。
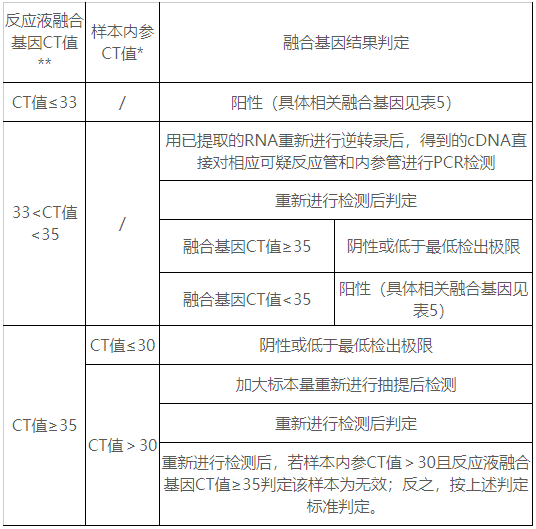
表3相關融合基因?qū)?/span>
(五)穩(wěn)定性研究
申請人對本產(chǎn)品的實時穩(wěn)定性、凍融穩(wěn)定性等進行了研究,確定了在各種條件下本產(chǎn)品的有效保存時間。同時,分別對骨髓樣本和抽提后的RNA保存條件、凍融時間及凍融次數(shù)進行了研究確定了臨床樣本的保存條件。
實時穩(wěn)定性研究:將三批試劑盒在-20℃±4℃冰箱中儲存0、10、15、18個月后分別進行一次成品檢驗,結(jié)果表明試劑盒在常規(guī)儲存條件下18個月后檢測結(jié)果均符合技術(shù)要求,故本試劑盒常規(guī)穩(wěn)定性定為:儲存條件-20℃±4℃,儲存18個月。
凍融次數(shù)研究:使用一批試劑盒進行開蓋試驗,具體操作流程如下:在-20℃±4℃冰箱中存放的試劑盒2盒,每5天左右拿出一次,將試劑完全融解后,將試劑完全融解,開蓋2分鐘后再蓋好蓋子,放回-20℃±4℃冰箱中存放,每5天左右重復一次,連續(xù)5次,1個月后進行檢定,試劑盒準確性、特異性、檢測限性能穩(wěn)定,因此將試劑盒開蓋、反復凍融條件定為:有效期內(nèi)反復凍融4次,性能穩(wěn)定。?
三、臨床評價概述
申請人在蘇州大學附屬第一醫(yī)院、浙江大學醫(yī)學院附屬第一醫(yī)院、上海交通大學醫(yī)學院附屬上海兒童醫(yī)學中心和首都醫(yī)科大學附屬北京兒童醫(yī)院共四家臨床試驗機構(gòu)完成了臨床試驗。采用試驗體外診斷試劑與染色體核型分析、Sanger測序法以及已上市同類產(chǎn)品分別進行比較研究,對產(chǎn)品臨床性能進行評價。入組病例主要包括急性髓系白血病、急性淋巴細胞白血病和慢性粒細胞白血病等血液病患者,樣本類型為骨髓樣本。臨床試驗共入組受試者樣本1103例,包括74例核型分析失敗患者樣本,其中融合基因陽性樣本639例,陰性樣本464例;融合基因陽性樣本中包括BCR-ABL陽性172例、AML1-ETO陽性100例、PML-RARα陽性100例、E2A-HLF陽性9例、MLL-AF4陽性30例、SIL-TAL1陽性16例、E2A-PBX1陽性22例、TEL-AML1陽性50例、CBFβ-MYH11陽性40例、DEK-CAN陽性16例、MLL-AF6、MLL-AF10、MLL-ELL、MLL-ENL聯(lián)合檢測陽性61例、MLL-AF9陽性23例。
經(jīng)統(tǒng)計核驗,試驗體外診斷試劑與染色體核型分析對比,臨床靈敏度為99.76%(95%CI:98.63%,99.96%),臨床特異度為74.56%(95%CI:70.99%,77.82%),不一致樣本采用Sanger測序法復核,并結(jié)合臨床分子分型結(jié)果進行分析,測序結(jié)果以及臨床分子分型結(jié)果與試驗體外診斷試劑檢測結(jié)果100%一致。分析原因,不一致結(jié)果主要是因為染色體核型分析檢測融合基因靈敏度偏低導致。74例核型分析失敗樣本檢測結(jié)果,試驗體外診斷試劑與Sanger測序法檢測結(jié)果符合率100%。
試驗體外診斷試劑與Sanger測序法對比試驗結(jié)果顯示,兩種方法針對每一種被測融合基因檢測陽性符合率、陰性符合率均為100%;收集臨床機構(gòu)針對受試者的分子分型診斷結(jié)果,試驗體外診斷試劑針對被測融合基因檢測結(jié)果與臨床機構(gòu)分子分型診斷結(jié)果100%一致。
試驗體外診斷試劑與BCR-ABL、AML1-ETO、PML-RARα已上市同類產(chǎn)品對比試驗分別檢測臨床樣本200例,結(jié)果顯示,BCR-ABL陽性符合率100%(95%CI:90.36%,100%),陰性符合率100%(95%CI:97.71%,100%);AML1-ETO陽性符合率100%(95%CI:92.44%,100%),陰性符合率100%(95%CI:97.55%,100%);PML-RARα陽性符合率100%(95%CI:91.24%,100%),陰性符合率100%(95%CI:97.66%,100%)。
綜上所述,該產(chǎn)品臨床試驗設計符合《體外診斷試劑臨床試驗技術(shù)指導原則》的相關要求。臨床試驗結(jié)果顯示該產(chǎn)品臨床靈敏度、臨床特異度滿足臨床要求。?
四、產(chǎn)品受益風險判定
根據(jù)申請人提供的申報資料,經(jīng)綜合評價,在目前認知水平上,認為該產(chǎn)品的上市為適用人群帶來的受益大于風險。但為保證用械安全,基于對主要剩余風險的規(guī)避,需在說明書中提示以下信息:
本試劑盒檢測結(jié)果僅供臨床參考,不得作為臨床診斷的唯一標準。建議結(jié)合患者臨床表現(xiàn)和其他實驗室檢測對病情進行綜合分析。
本申報項目為境內(nèi)第三類醫(yī)療器械產(chǎn)品注冊,屬于境內(nèi)同品種首個產(chǎn)品。申請人的注冊申報資料符合現(xiàn)行要求,依據(jù)《醫(yī)療器械監(jiān)督管理條例》(國務院令第680號)、《體外診斷試劑注冊管理辦法》(國家食品藥品監(jiān)督管理總局令2014年第5號)等相關醫(yī)療器械法規(guī)與配套規(guī)章,經(jīng)系統(tǒng)評價后,建議準予注冊。
2022年2月24日
附件:產(chǎn)品說明書