醫(yī)療器械創(chuàng)新網(wǎng)

受理號(hào):JQZ2100255
醫(yī)療器械產(chǎn)品注冊(cè)技術(shù)審評(píng)報(bào)告
產(chǎn)品英文(原文)名稱:
Shockwave Peripheral Intravascular?Lithotripsy (IVL) Catheter?
Shockwave Medical, Inc.
5403 Betsy Ross Drive Santa Clara,CA USA 95054
5403 Betsy Ross Drive Santa Clara,CA USA 95054
技術(shù)審評(píng)概述
表1冠脈臨床研究概況
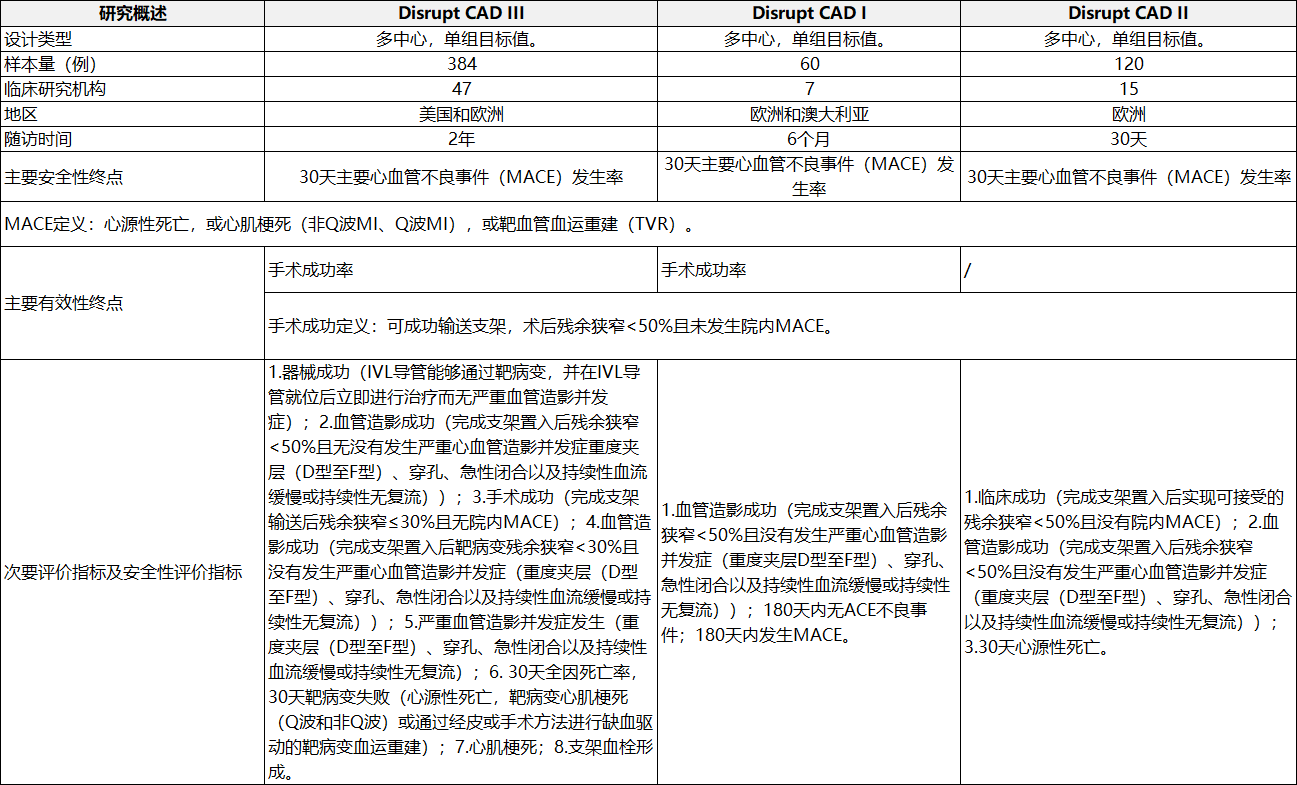
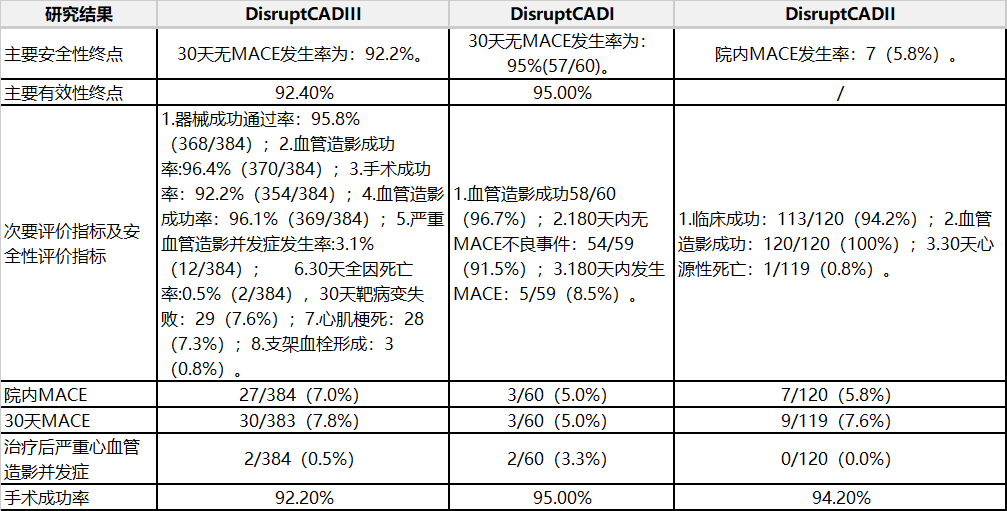
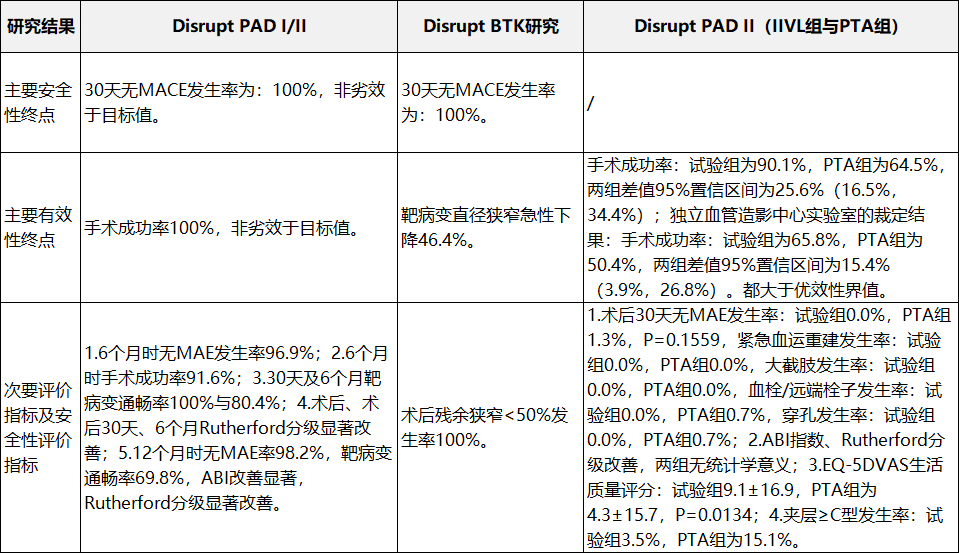
表3外周臨床研究概況

綜合評(píng)價(jià)意見
2022年5月6日